こんにちはmasayaです。
以前の投稿 “製薬企業の研究職(基礎研究)の仕事内容“で、創薬研究の中で低分子化合物を見つけるためには大規模な化合物群の中からスクリーニングを行い、有効な化合物の候補を見つけてくる必要があることについて紹介しました。
しかしながら現在、難易度の低い創薬ターゲットはどんどん減ってきて難易度の高い創薬ターゲットが増えてきています。そんな難易度が高い創薬ターゲットへどうアプローチしていくかというのが課題ですが、『DNA encoded library』という手法がとてもインパクトのあるものだったので、既存のスクリーニング方法(ハイスループットスクリーニング: High Throughput Screening, HTS)と併せてまとめてみました。
1. DNA encoded libraryとは?
1-1. 創薬研究におけるDNA encoded libraryの役割
『DNA Encoded Library (DEL)』とは創薬研究で薬の候補となる低分子化合物をスクリーニングしてくる手法の一つで、近年とても注目を集めています。
製薬企業の基礎研究のステージではシンプルに3つに分けて、
- 疾病に関連した標的タンパク質の選定
- 標的タンパク質に対する化合物のスクリーニング
- 化合物の合成の繰り返し、ブラッシュアップ
があります、DELは2番目の『標的タンパク質に対する化合物のスクリーニング』の段階に大きく関連しています。
2-2. DNA encoded libraryの仕組み
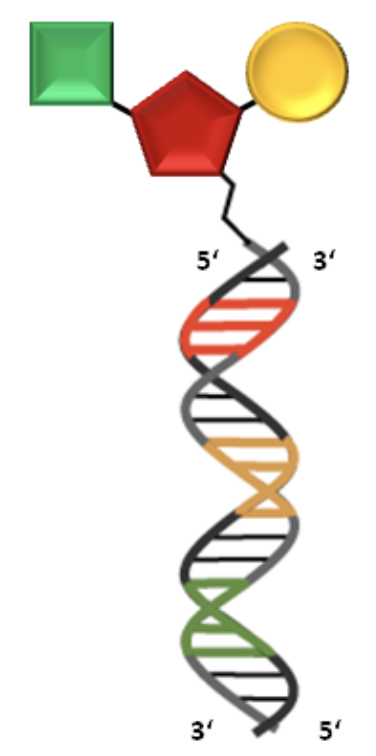
DNA encoded library (DEL)の仕組みは中々興味深くて、スクリーニング対象の個々の化合物に『バーコード』のように各化合物特有のDNAがくっ付けられています。
原理としては、標的タンパク質に結合してくる化合物のバーコード(DNA)をPCR (Polymerase Chain Reaction)でシグナルを増幅させます。最終的にはDNA配列の解析から、どの化合物が実際に標的タンパク質に結合したのかを同定します。
DNA encoded library (DEL)のワークフロー
- 標的タンパク質の精製
- 標的タンパク質をDNA encoded libraryの化合物群と混ぜる
- 標的タンパク質に結合しなかった大多数の化合物を洗い流しす
- 標的タンパク質に結合してきた化合物のDNAの読み取り
- ヒットした化合物からDNAを除いた化合物の合成 (Off-DNA synthesis)
- 化合物の標的タンパク質に対する活性評価試験
ヒットしてくる化合物達はあくまでも標的タンパク質との『結合』を基準に取ってくるので、もちろん標的タンパク質の活性を変化させない化合物も多く含まれています。
多くの創薬研究プロジェクトは標的タンパク質の活性を変化させる(活性化もしくは阻害)化合物を探しているので、DELでヒットしてきた化合物に対する活性評価試験がDELを使ったスクリーニングの後には必要になってきます。
参考までに、NovartisのDNA encoded libraryのムービーが簡潔でとても分かりやすいので、英語ですが是非下のムービーを見てみて下さい。
ムービーが見れなければ、“こちら”からどうぞ
2. ハイスループットスクリーニングとは?
2-1. 創薬研究におけるHTSの役割
『ハイスループットスクリーニング: High Throughput Screening (HTS)』はこれまでの創薬研究の化合物のスクリーニング過程における主役の方法の一つです。
HTSもDELと同様に製薬企業の基礎研究の3つのステージのうちの2番目の『標的タンパク質に対する化合物のスクリーニング』の段階に大きく関連しています。
- 疾病に関連した標的タンパク質の選定
- 標的タンパク質に対する化合物のスクリーニング
- 化合物の合成の繰り返し、ブラッシュアップ
2-2. HTSの仕組み
HTSでは96個もしくは384個の穴を持ったプレート内の1つ1つの小さな穴の中で標的タンパク質とスクリーニング対象の化合物を反応させて、そのアウトプットを計測してヒット化合物を同定します。
By Sigma Aldrich
ハイスループットスクリーニングのワークフロー
- 標的タンパク質とその基質の精製/準備
- HTSの反応条件の最適化
- 標的タンパク質・基質と化合物群を96穴/384穴プレート内で反応させる
- 標的タンパク質による基質の変化を測定
- 変化量が多い化合物をヒット化合物として同定
HTSの最適な反応条件は標的タンパク質と基質に依存するので、プロジェクト(標的タンパク質)毎に最適な条件をテストして見出す必要があります。
また、この時HTSでヒットしてくる化合物はDELのように『結合』ではなく『活性』を基準に同定されてきます。
その後、そのヒット化合物が本当に標的タンパク質に結合しているのかどうかを確認するのための結合評価実験をするかどうかは、プロジェクトの質やプロジェクトチームの判断に寄ると考えられます。
3. スクリーニングの化合物群の大きさ
DELとHTS、どちらもスクリーニングの方法ですが、スクリーニング可能な化合物群(Chemical Space)の数が全く異なっています。
HTSではスクリーニングの化合物群の数は『millions: 1,000,000』、100万個スケールだと言われています。
しかしDELで行うスクリーニングの化合物群の数は『billions: 1,000,000,000』、10億個スケールです。
HTSよりも1000倍以上多くのバリエーションの化合物群の中から、未だ見ぬヒット化合物を探してくることが可能になります。
創薬研究で化合物を探すのは、『A needle in a haystack』(探すエリアが広すぎて不可能、非常に難しい)と時々表現される程難しいので、より広い範囲から探せば難易度の高い創薬ターゲットに対するヒット化合物が見つかる確率がアップすることが期待されます。
4. DNA encoded library(DEL)のメリットとデメリット
もちろんDNA Encoded Library (DEL)がハイスループットスクリーニング (High Throughput Screening: HTS)に比べて全ての面で優れているというわけではありません。
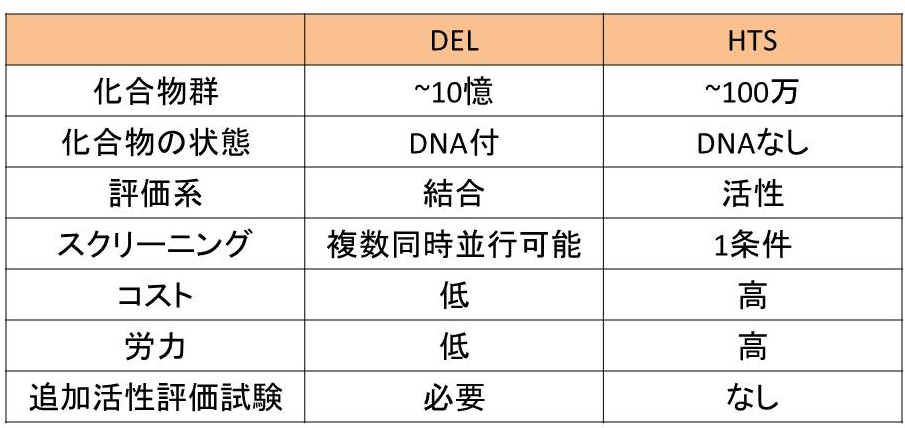
下にDELとHTSの特徴の比較を簡単にまとめてみましたが、どちらにもメリットとデメリットがあるのが分かるかと思います。
まず目を惹くDELのメリットは先程も述べたようにスクリーニング対象の化合物群の数が多いことです。
また、それと同じくらい大きなメリットが、『スクリーニングを複数同時並行で行うことが可能』な点です。HTSでは基本的には1つの最適化した条件の下で化合物のスクリーニングを行うので、このDELの複数条件の同時並行スクリーニング(下の例参照)はHTSにと比較して大きなアドバンテージだと言えます。
例: DELのスクリーニング戦略の例
- 標的タンパク質(低濃度)のみ
- 標的タンパク質(低濃度)+既存の阻害剤
- 標的タンパク質(高濃度)のみ
- 標的タンパク質(高濃度)+既存の阻害剤
HTSと比較したときのDELのデメリットとしては、DELは標的タンパク質と化合物との間の『結合』を評価基準にしているので、DELによるヒット化合物の同定後には標的タンパク質の『活性』を変化させているかどうかを評価する必要があります。HTSでは『活性』を基準にスクリーニングをしているので再試験は基本的には必要ありません。
下の3つの結果の例を見ながら、どうして結合を指標としたDELの後に活性を評価するのかについて少し紹介します。
例: ある標的タンパク質の阻害剤を探しているプロジェクトチームのDELによるヒット化合物
化合物A: 強い結合(DEL)→活性なし(活性評価試験)
化合物B: 強い結合(DEL)→活性化(活性評価試験)
化合物C: 中程度の結合(DEL)→阻害(活性評価試験)
上の例ではDELによるスクリーニングで3つの化合物が同定されましたが、化合物Aと化合物Bは標的タンパク質への強い結合を示したものの、その後の活性評価試験ではチームが求めていた標的タンパク質の活性を阻害しませんでした。それに対して、化合物Cは結はそこそこだったもののその後の活性評価試験では標的タンパク質の機能を阻害しました。
この結果を踏まえると『阻害剤』を探していたチームは標的タンパク質への阻害を示した化合物Cを今後発展させていく可能性が高いと考えらます。
5. DNA Encoded Librayの現状
DELはとても興味深いアプローチであり、現在下のようにいくつもの製薬企業が取り組んでいます。その中でもGlaxoSmithKline (GSK)がDELを使ったスクリーニングに関してはリードしている印象を持っています。
DELを取り入れている製薬企業 (2018年12月時点)
- GSK: 2007年にDELを行うPraecisという会社を買収
- AstraZeneca: DELを行うX-chemとのパートナーシップ
- Merck: DELを行うHitGenとパートナーシップ
- Pfizer: HitGenとのパートナーシップ
- J&J: HitGenとのパートナーシップ
- Novartisなどなど
“DNA-encoded chemistry: enabling the deeper sampling of chemical space”によるとDELによって同定された化合物の報告は2014年3月〜2016年6月の間にアカデミア・企業から19報あったようです。
その内でもGSKが関係した報告が12/19報だったことから、GSKが今のところDELをスクリーニング手法として使うことに関してはリードしていることが伺えます。
まとめ
- DNA Encoded Library (DEL)はバーコード(DNA)の付いた10億個スケールの化合物群からスクリーニングをするユニークな手法
- 今後難易度の高い標的へのスクリーニング手法としてDELの活躍が増えるかもしれない
- DELとハイスループットスクリーニング(HTS)にはどちらにもメリット・デメリットがあるのでプロジェクト毎に最適な手法が選択される
これまでの手法では難易度が高かった創薬ターゲットへどうアプローチしていくかというのが課題ですが、DELはそんなアプローチの一つとしてとても注目されています。今後『DNA Encoded Library』の名前を聞く機会が増えていくかもしれませんね。
製薬企業の基礎研究の仕事に興味のある方は、“製薬企業の研究職(基礎研究)の仕事内容“を合わせて読んでみてください。
最後までお付き合いいただき、ありがとうございました。
参考になった、面白かったと思って頂けたら是非シェアして下さい 🙂
【参考】
DNA-encoded molecules provide a new edge in cancer drug hunts
Using DNA ‘Barcode’ in the Search for New Drugs



「創薬研究のスクリーニング方法: DNA Encoded Libraryとハイスループットスクリーニング」への2件のフィードバック