こんにちは、masayaです。
以前の投稿で“High Throughput Screening (HTS)”、“DNA Encoded Library (DEL)”、“Affinity Selection Mass Spectrometry”、“表現型スクリーニング (Phenotypic screening)”などの創薬研究の低分子化合物のスクリーニング手法について紹介してきました。
今回は、前々から面白いなぁと感じていた創薬研究のアプローチの一つ『フラグメント創薬: Fragment-based drug design/discovery (FBDD)』という効率的なスクリーニング手法についてまとめました。
1. FBDDはStructure-Based Drug Design (SBDD)を利用する
以前の投稿“製薬企業の研究職(基礎研究)の仕事内容“でも少しSBDDについて触れましたが、SBDDは疾患タンパク質に立体構造情報を利用して低分子化合物をデザイン・最適化していくアプローチです。
SBDDのメリットは実際に化合物が結合するポケットを目視しながら化合物をデザインしたりシミュレーション出来たりすることです。
FBDDの基本的な考え方もSBDDと類似していて、疾患に関係していると考えられる標的タンパク質の立体構造情報を利用して、分子量200Da程度の小さな化合物フラグメントから薬の候補になり得るリード化合物をデザインします。
2. FBDDのスクリーニングの仕組み
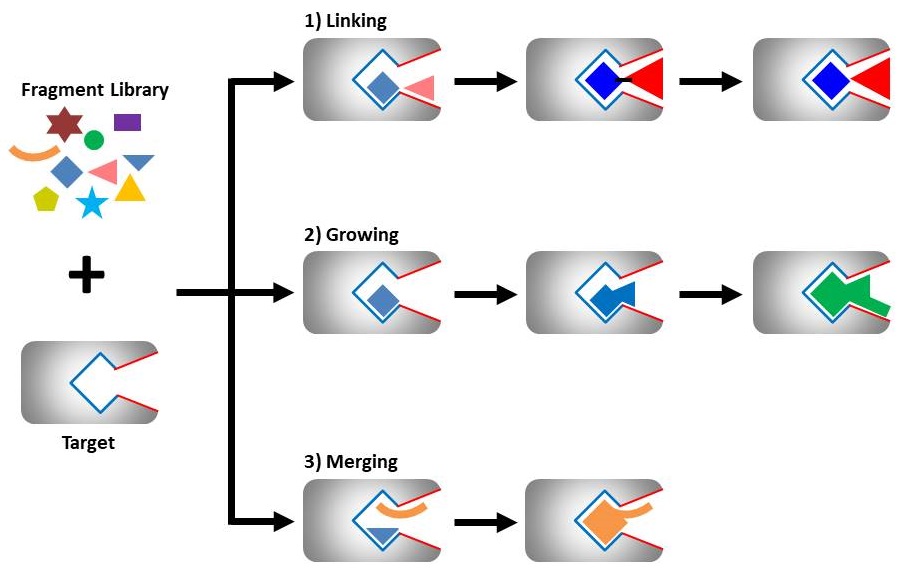
FBDDではどうやってスクリーニングを行なってリード化合物を見つけるのかですが、下の図に簡単にまとめました。
FBDDの仕組み・流れ
まずFBDDでは分子量200Da程度のサイズの小さな化合物群(Fragment library)と疾患に関与している標的タンパク質を混ぜ合わせてスクリーニングを行い、最初のヒットフラグメントをいくつか見つけます。
この際FBDDで使用する化合物群(Fragment library)に含まれる化合物の数は1000〜5000個程度と、ハイスループットスクリーニングの化合物群(library)に含まれる化合物の数(Millions)やDNA Encoded Libraryの化合物群(library)に含まれる化合物の数(Billions)に比べると圧倒的に少ないのが特徴です。
しかし化合物群に含まれる化合物の数は少ないですが、そこに含まれるフラグメントは毒性の低いものや可溶性の高いものなだと性質の良い化合物が多く含まれています。
得られたヒット化合物のフラグメントと標的タンパク質のポケットの形をみながら、①Linking、②Growing 、③Mergingと呼ばれる3つのアプローチでヒット化合物のフラグメントを標的タンパク質上のポケットにフィットするように最適化していきます。
3つの方法に分類されていますが、基本的なコンセプトは『標的タンパク質のポケットの形へ適した化合物をデザインする』ことです。
このデザインの際には主にX線結晶構造解析と呼ばれるタンパク質の立体構造と化合物の結合状態を原子レベルで観察する手法が用いられます。
最終的に性質の良い化合物が見つかれば、その化合物が『リード化合物』(薬の候補)となってその後の毒性試験や薬効試験などの前臨床段階へと入り、上手くその壁を乗り越えることができれば臨床試験が開始されます。
3. FBDDのプロジェクトの流れ
このFBDDを使ってリード化合物を取ってくるプロジェクトの流れは、いくつかの文献を見ている感じだと下のフローのようになるんじゃないかと考えられます。
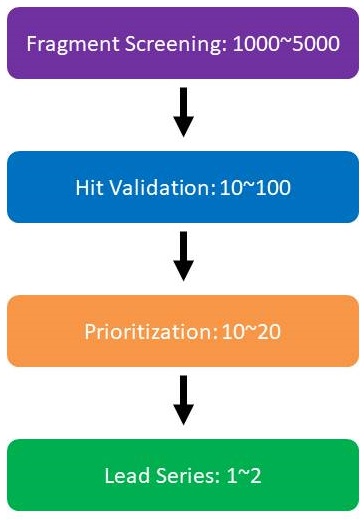
FBDDを利用するプロジェクトの流れ
1: Fragment screening: 1000~5000
まず第1段階(上図の紫)で標的タンパク質と1000〜5000個スケールの化合物群(Fragment library)とのスクリーニングを行います。
この最初のスクリーニングではNMR(Nuclear Magnetic Resonance: 核磁気共鳴)やSPR(Surface Plasmon Resonance: 表面プラズモン共鳴)と呼ばれる弱い相互作用の化合物も観測できる方法が用いられることが一般的です。
2. Hit validation: 10~100
このスクリーニングでヒット化合物(上図の青色)が取れてくれば、Hit validationとして、その化合物が本当に偽陽性ではなく本当にポジティブかどうかを確認するためのアッセイを行います。この段階では、標的タンパク質の性質によって10〜100個もしくはそれ以上のヒット化合物が得られることになってきます。
このアッセイの一例を標的タンパク質が活性ポケットを持つ酵素だった場合でみていきます。ヒット化合物のフラグメントがこのポケットに結合する化合物であるならば、基質などの酵素本来の結合相手と競合するはずです。
そこでこの競合する相手を蛍光などのラベルをつけておくことで、ヒット化合物とラベル化基質の競合が観測できるはずです。
ここでヒット化合物が競合しないタイプ、ポケット外の部分に結合して標的タンパク質の活性を変化させるアロステリックな化合物も、もしかしたら見つかるかもしれない点は注意が必要です。
3. Prioritization: 10~20
ここである程度優先度の高い低いを見極めて(Prioritization: 上図のオレンジ色)10〜20個程度の化合物を選び、X線結晶構造解析やシミュレーションを行なって標的タンパク質とヒット化合物の立体構造もしくはモデルを求めていくことになります。
標的タンパク質とヒット化合物(フラグメント)の複合体の立体構造やモデルを見ながら、上述のFBDDの仕組みでも触れたように、フラグメントをポケットに最適な形になるように成長させてリード化合物をみつけていくことになります。
4. Lead Series: 1~2
最終的に1つもしくは2つのリード化合物が見つかれば、そのリード化合物が次のステージ、前臨床試験のフェイズへと移行していきます。
リード化合物を全臨床試験へ送り出すことが製薬企業での基礎研究のゴールの一つなので、この段階にくればプロジェクトチームにとって喜ばしいことです。
4. FBDDの実例
“Practical Fragments – Fragments in the clinic”によると、現在多くの薬の候補が臨床試験の段階もしくは市場に出ているようです。その中からFBDDの実例を2つ以下に紹介します。
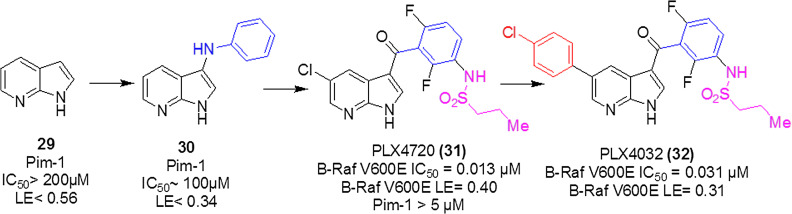
例①: Vemurafenib, 標的はB-Raf (V600E) (Plexxikon)
From “The Practice of Medicinal Chemistry P176”
上記のVemurafenibの例では、最初のヒットフラグメント(図の左側の29)から右側に向かって青色、赤色やピンク色のピースが付加されていき、徐々にフラグメントが改良されていって最終的にリード化合物PLX4032にたどり着きます。
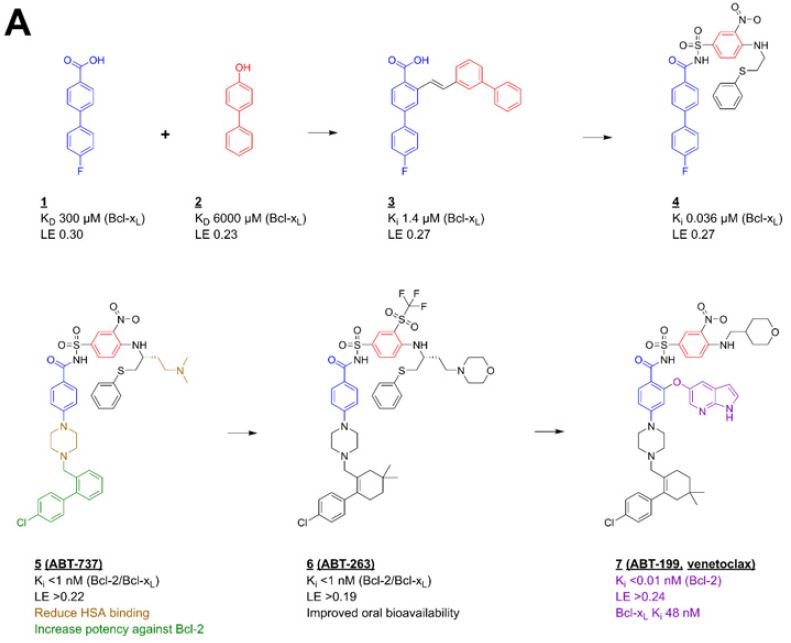
例②: Venetoclax, 標的はBcl-x (Abbvie/Genentech)
From “Lamoree B. and Hubbard R. Essays in Biochemistry (2017)”
上のVenetoclaxの例では、最初にヒットした2つのフラグメント(図の左上の1と2の化合物)を結合させて(Linking)からフラグメントを最適化していき、最終的にリード化合物ABT-199(図に右下の化合物)を得ることに成功したようです。
5. FBDDのメリットとデメリット
FBDDのメリット
1つ目に、ヒットフラグメントは標的タンパク質のポケットに良くハマるので、ヒットが得られれば良いスタート地点から最適化を始めることが可能です。
2つ目に、FBDDのヒットフラグメントはハイスループットスクリーニング(HTS)などのスクリーニングのヒット化合物よりも小さいので、毒性が低いや薬物代謝の面で有利などの性質の良さが期待できます。
3つ目に、FBDDで使用する化合物群(Fragment library)に含まれる化合物の数は1000〜5000程度とハイスループットスクリーニング(HTS)のMillions個スケールと比べるとはるかに少ないので、化合物群(Fragment library)を維持しやすい点が挙げられます。
FBDDのデメリット
スクリーニングに用いる化合物群のフラグメントは標的タンパク質との相互作用はとても弱いことが多いので、測定手法によってはヒットしてこなかったり、モデルを得る難易度が高い場合があります。
また、標的タンパク質とフラグメントの結合状態の構造を知ることがFBDDにとっては重要なので、X線結晶構造解析を行うことが出来ない標的へは応用が難しい場合もあります。
6. FBDDの展望
FBDDは標的タンパク質上のポケットの形をみながら、最適な形にフィットする化合物を小さなフラグメントからデザインしていく効率的でともて面白いアプローチです。
既存のハイスループットスクリーニング(HTS)などのスクリーニング手法でヒット化合物が得られない場合などに、FBDDが有効なケースもあることから今後も注目のスクリーニング手法の一つであることが予想されます。
しかしながら、FBDDを効率的に進めていく上では標的タンパク質-化合物(フラグメント)の複合体構造もしくは精度の良いモデルを効率良く得られるシステムが必要なので、そのあたりがFBDDにとってのチャレンジだと考えられます。
まとめ
- Fragment-Based Drug Design/Discovery (FBDD)はタンパク質の立体構造情報を利用して小さなフラグメントからリード化合物を作る効率的な創薬のアプローチ
- ハイスループットスクリーニング(HTS)などの他の手法と比較して、FBDDは維持する化合物の数が少なく、また性質が良い
- 現在もFBDDを利用した多くの化合物が市場もしくは臨床試験段階にあり、今後も創薬研究の重要なオプションの1つであることが予想される
パズルのように小さなピースを組み立てたり、繋げたりするFBDDのアプローチはとても面白いものだと感じます。
最後までお付き合いいただき、ありがとうございました。
参考になった、面白かったと思って頂けたら是非シェアして下さい 🙂
【参考】
- “How Fragment-Based Drug Screening is Like the ‘Tetris’ of Drug Design”
- “Discovery of clinical candidate IRAK4 by Fragment-Based Drug Design”
- “Current perspectives in fragment-based drug lead discovery (FBLD)”